Kommunikationslöcher: Ionenkanäle
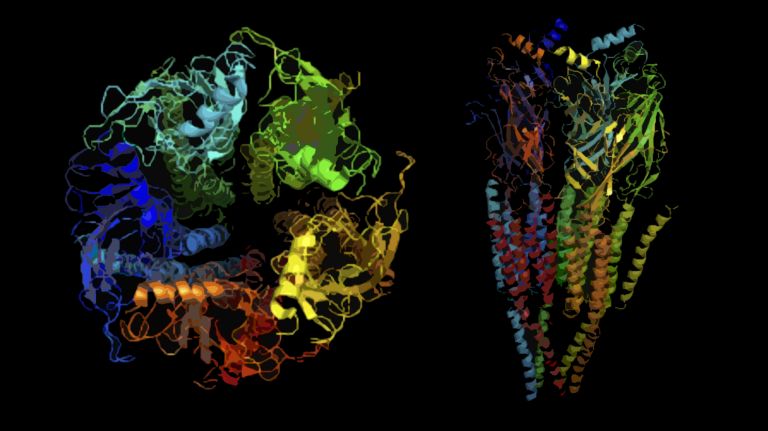
In Ionenkanälen verbirgt sich der Schlüssel zum Verständnis der elektrischen Aktivität von Nervenzellen. Ohne sie läuft buchstäblich: Nichts.
Scientific support: Prof. Dr. Helmut Kettenmann
Published: 01.12.2020
Difficulty: intermediate
- Ionenkanäle sind integrale Membranproteine, die in allen Zellen vorkommen und sich durch drei Eigenschaften auszeichnen: Sie lassen Ionen durch die ansonsten undurchlässige Membran passieren, sie tun dies (relativ) spezifisch nur für bestimmte Ionen, und sie öffnen und schließen auf spezifische elektrische, chemische oder mechanische Signale.
- Ionenkanäle lassen sich in drei Gruppen einteilen: Spannungsabhängige Ionenkanäle, ligandengesteuerte Ionenkanäle, und mechanisch aktivierte Ionenkanäle.
- Viele Krankheiten lassen sich auf Veränderungen in der Struktur von Ionenkanälen zurückführen.
- Viele Arzneien, Drogen und Gifte wirken als Liganden an Rezeptoren für Botenstoffe.
Eine wesentliche Fähigkeit des Gehirns ist es, reagieren zu können. Kurzfristig, und auf Stimuli, die von innen wie von außen kommen. Man kann das als die Hauptfunktion des Nervensystems auffassen: Signale empfangen, weiterleiten, darauf reagieren. Dabei genügen teilweise erstaunlich kleine Reize, um in einer Nervenzelle ein elektrisches Signal auszulösen. In den Photorezeptoren unserer Netzhaut kann dafür ein einziges Photon ausreichen. Durch diese kaum vorstellbar winzigen Reize kommt es zu einer Änderung der elektrischen Spannung über der Membran der Nervenzellen, welche diese Änderung als Signal über teils erstaunliche Strecken weiterleiten, bis wir sie wahrnehmen und darauf reagieren können. All das basiert auf der Struktur und Funktion von Ionenkanälen. In ihnen verbirgt sich der Schlüssel zum Verständnis der elektrischen Aktivität von Nervenzellen und der Vielseitigkeit ihrer Signale.
Was sind Ionenkanäle?
Ionenkanäle sind große Proteine, die in der Membran aller Körperzellen vorkommen. Sie durchziehen die Membran, schauen innen wie außen hervor, man nennt sie daher integrale Membranproteine. Die Ionenkanäle in Neuronen unterscheiden sich nicht prinzipiell von denen anderer Körperzellen. Je nachdem in welcher Zelle sie vorkommen, verantworten verschiedene Ionenkanäle unterschiedliche Aufgaben. Aber allen gemeinsam sind drei wesentliche Eigenschaften:
- Sie lassen Ionen durch die ansonsten undurchlässige Membran passieren,
- Sie tun dies (relativ) spezifisch nur für bestimmte Ionen, sind also selektiv,
- Sie öffnen und schließen durch spezifische elektrische, chemische oder mechanische Signale.
Was die neuronalen Ionenkanäle besonders macht, ist ihre Schnelligkeit und ihre hohe Leitfähigkeit. Um genau zu sein: etwa 12 Millionen Ionen pro Sekunde. Genau dieser massive Fluss elektrischer Ladungen bildet die Grundvoraussetzung für die Möglichkeit, den Mechanismus zur Signalübertragung zu nutzen. Auch wenn der Strom, der dabei entsteht, nur knapp zwei Picoampere beträgt, also zwei Billionstel Ampere. Erstaunlich dabei ist, wie selektiv (wenn auch nicht exklusiv) die Kanäle hinsichtlich der Ionen sind, die sie passieren lassen. So sind Kaliumkanäle etwa hundertfach leitfähiger für Kalium als für Natrium, während Natriumkanäle etwa zwanzigfach leitfähiger für Natrium als für Kalium sind. Außer den positiv geladenen Ionen (Kationen) wie Natrium und Kalium wird auch die Passage negativ geladener Ionen (Anionen) reguliert, wie beispielsweise Chlorid. Das Funktionsprinzip ist aber immer dasselbe.
Wie funktionieren Ionenkanäle?
Den Kanälen selbst stehen funktionell die Pumpen gegenüber, meist sehr komplexe Proteine, die ebenfalls in der Membran sitzen. Sie sind es, die Natrium und Kalium voneinander trennen. Sie wenden Energie auf, um fortwährend Natrium und Chlorid aus der Zelle heraus- und das Kalium hineinzupumpen. Und weil diese Substanzen eben Ionen sind, also elektrisch geladene Teilchen, entsteht durch deren ungleiche Verteilung eine elektrische Ladung oder Polarität. Über der Membran besteht also eine Spannung, die in Volt angegeben wird. Nervenzellen sind im Ruhezustand etwa 70 Tausendstel Volt negativer geladen als ihre Umgebung. Diese Zahl zu verringern, also die Spannung abzubauen oder die Zelle zu depolarisieren, bedeutet, dass Energie frei wird: die Zelle ist erregt. Umgekehrt bedeutet die Zahl zu vergrößern, Spannung also aufzubauen und die Zelle zu hyperpolarisieren, dass die Zelle gehemmt wird. Sowohl das Membranpotential, als auch die Konzentrationsunterschiede zwischen den Ionen im Inneren und außerhalb der Zelle sind entscheidend dafür, ob und wie die Nervenzelle auf einen Reiz reagiert. Um zu verstehen, wie es sein kann, dass jeder Kanal (fast) nur eine Art Ion hindurchlässt, muss man sich sowohl die Ionen wie auch Kanäle etwas genauer ansehen:
Natrium und Kalium tragen beide jeweils eine positive Ladung. Weil Natrium aber kleiner ist, verteilt sich diese Ladung auf weniger Raum, woraus sich für Natrium ein größeres elektrisches Feld ergibt. Wasser ist zwar nach außen hin elektrisch neutral, besitzt aber trotzdem eine gewisse Polarität. Die Wassermoleküle scharen sich um geladene Teilchen, man spricht von der Hydrathülle, die beim eigentlich kleineren Natrium durch das stärkere Feld eben etwas größer als bei Kalium ist. Die reine Größe der Ionen samt Hydrathülle ist aber nicht ausschlaggebend für die Selektivität der Kanäle. Sie könnte ohnehin nur die Selektivität der Kaliumkanäle erklären. Relevanter ist die Kanal-Innenwand. Dort befinden sich Aminosäuren, die ebenfalls Ladungen tragen. Die Regionen mit geladenen Aminosäuren fungieren wie eine Art molekulares Sieb, dass die einzelnen Ionen selektiert. Weil die Kanalpore zu klein ist, um ein Ion mit samt der Hydrathülle passieren zu lassen, verlieren die Ionen hier ihren Wassermantel. Für eine sehr kurze Zeit wechselwirkt das Ion mit den Aminosäuren, die es auf dem Weg durch den Kanal durch die elektrostatischen und Diffusionskräfte beschleunigen und durch die Kanalpore drücken. Das funktioniert aber nur dann richtig gut, wenn die Energie, die die geladenen Aminosäuren zur Verfügung stellen, dem Wert entspricht, den das Ion durch den Verlust seiner Wasserhülle verliert. So kann man allein aus der Struktur des Kanalproteins darauf schließen, welches Ion es selektiert. Denn Aminosäuren mit hoher Ladung, wie Aspartat oder Glutamat, wechselwirken stärker mit dem größeren Feld von Natriumionen, geben ihm dadurch mehr Schwung und selektieren so dieses Kation. Trägt die Kanalinnenseite Aminosäuren mit geringerer Ladung, bevorzugt dieser Kanal eher Kalium, weil Natrium nicht genug Energie enthält, um durch den Kanal gedrückt zu werden.
Wie öffnen und schließen Ionenkanäle?
Davon abgesehen ist die Gestalt der Kanalproteine noch für etwas anderes verantwortlich. So ein Kanal ist kein dauerhaft offenes Loch in der Membran. Sonst wäre der durch die Pumpen aufgebaute Ionengradient innerhalb kürzester Zeit abgebaut. Es gibt also Öffnungs- und Schließmechanismen, man spricht auch von "gating". Genauer gesagt gibt es drei, wodurch sich Kanäle in drei prinzipielle Klassen einteilen lassen:
- Spannungsabhängige Ionenkanäle,
- Ligandengesteuerte Ionenkanäle,
- Mechanisch aktivierte Ionenkanäle.
Wenn die Innenseite des Kanals mit dem Cytoskelett der Zelle verbunden ist, dann können Zug-, Druck- oder Scherbewegungen die Pore öffnen oder schließen. Und im Ergebnis entsteht ein mechanisch aktivierbarer Ionenkanal.
Die Spannungsabhängigkeit von Kanälen ergibt sich daraus, dass die in der Kanalpore fest gebundenen, geladenen Aminosäuren zwar ihren Platz nicht verlassen können, aber natürlich trotzdem auf das Membranpotential reagieren. Die Spannung verschiebt die Ladung tragenden Aminosäuren soweit, bis die Kanalpore unpassierbar wird. Erst wenn die Spannung abgebaut wird, richtet sich die Kanalpore gerade und der Kanal ist passierbar.
Aus diesem genialen Mechanismus ergeben sich aber auch Probleme. Zumindest dann, wenn Gene, die für Ionenkanäle kodieren, an einer für den Öffnungsmechanismus relevanten Stelle mutiert sind. So kann bereits die Veränderung an einem einzigen Erbgut-Baustein dazu führen, dass ein Kanal weniger oder ein anderer übermäßig leitfähig für bestimmte Ionen wird. Dann reagieren die Nervenzellen auf ein Eingangssignal vielleicht nicht mit einem Ausgangssignal, sondern mit einer ganzen Serie. Dieser Mechanismus liegt beispielsweise einigen Formen der Epilepsie zugrunde. Hier kommt auch noch einmal das Anion Chlorid ins Spiel. Denn die positiv geladenen Kationen brauchen einen Gegenspieler, sonst schießt die durch sie getragene Aktivität über und nichts kann sie aufhalten.
Hemmung und Erregung bilden ein präzises Gleichgewicht, das durch solch winzige Veränderungen leicht aus der Balance geraten kann. Mit teilweise dramatischen Folgen. Das zeigt deutlich, warum es klinisch so hochrelevant ist, sich intensiv mit Ionenkanälen zu beschäftigen. Und, warum die ligandengesteuerten Ionenkanäle in dieser Disziplin so intensiv beforscht werden. Denn die Spannungsabhängigkeit eines Kanals lässt sich nach der Entwicklung kaum ändern.
Ligandengesteuerte Ionenkanäle hingegen öffnen sich erst, wenn ein Signalmolekül, beispielsweise ein Botenstoff oder Neurotransmitter, auf der Außenseite bindet. Auch das führt dazu, dass sich die Gestalt des Kanalproteins etwas verändert und die Pore sich öffnet. Mit dieser Konformationsänderung nimmt das Nervensignal in der Postsynapse seinen Anfang. Positiv geladene Natriumionen strömen in die Zelle, und Kalium nach außen. Das lässt die Spannung absinken, die Zelle depolarisiert, bis die spannungsabhängigen Natriumkanäle öffnen. Und zwar alle gleichzeitig. Der massive Einstrom lässt das Potential bis weit ins Positive überschießen, es entsteht ein großes elektromagnetisches Feld, das bis über die Hüllzellen hinauswirkt und weiter entfernte spannungsabhängige Kanäle öffnet. Das Signal springt also über die Hüllzellen, weshalb man von saltatorischer Reizleitung spricht.
Ansatzpunkt für Gifte und Arzneien
Weil all das damit beginnt, dass ein Transmitter an den Rezeptor bindet, und weil dieser den dazu gehörigen Kanal durch eine Konformationsänderung öffnet, die davon abhängt, wie das Transmittermolekül aussieht, entsteht hier die Möglichkeit, regulierend einzugreifen. Man muss „nur“ ein Molekül finden, das dem natürlichen Transmitter ähnlich genug ist, um an den Rezeptor zu binden, aber verschieden genug, um das Kanalprotein auf andere Art und Weise zu verbiegen. So kann man, etwa durch den Einsatz bestimmter Medikamente, Ionenkanäle dazu bringen, sich länger oder kürzer, schneller oder langsamer zu öffnen oder zu schließen. Genau dies geschieht bei der Epilepsie-Behandlung, wenn übermäßig leitfähige spannungsabhängige Kanäle gedämpft werden.
Ein Großteil der pharmakologischen Arbeit besteht darin, Substanzen zu finden, die den natürlichen Botenstoffen verwandt sind, aber an den Rezeptoren etwas anders wirken. Dann gilt es herauszufinden, wie sich dies auf das Gesamtsystem auswirkt. Auch die Natur greift darauf zurück. So sind viele Gifte, die im Naturreich vorkommen, Substanzen, die mit Ionenkanälen mal reversibel (Pfeilgift Curare) oder mal dauerhaft (Schlangengift Alpha-Bungarotoxin) interferieren.
Die Ionenkanäle sind also nicht nur der Schlüssel für die elektrische Aktivität der Nervenzellen und somit für unsere Bewegungsfähigkeit, die Fähigkeit Reize aus der Umwelt aufzunehmen oder auf sie zu reagieren, zu fühlen oder zu denken. Sie sind auch entscheidend für das Verständnis vieler Krankheiten. Das Wissen um Aufbau und Funktion der Ionenkanäle kann dazu beitragen, spezifische Therapien zu entwickeln, um neurologische und psychische Krankheiten zu behandeln.
Zum Weiterlesen
- Ion Channells in "Principles of Neural Science" 5th Edition, Eric Kandel (Hrsg.), New York, 2013

