Das Nervensystem reparieren
Beim Menschen verursachen Verletzungen des Nervensystems und neurodegenerative Krankheiten meist dauerhafte Schäden. Womöglich schlummert in uns aber ein Selbstheilungspotential, das sich für künftige Therapien nutzen lässt.
Scientific support: Prof. Dr. Constanze Seidenbecher
Published: 30.04.2020
Difficulty: intermediate
• Beim Menschen regenerieren sich Schäden am Gehirn und Rückenmark normalerweise nicht. Die Folge sind dauerhafte Beeinträchtigungen wie Lähmungen oder Verlust kognitiver Fähigkeiten.
• Manche Tiere, zum Beispiel der Zebrafisch, besitzen die Fähigkeit, abgestorbene Nervenzellen zu ersetzen, und können so beschädigte neuronale Netzwerke wieder reparieren. Neurobiologen versuchen, die Mechanismen dieser Selbstheilung zu entschlüsseln.
• Die Erkenntnisse sollen dazu dienen, die Reparatur auch beim Menschen gezielt in Gang zu setzen. Das kann etwa über das Umprogrammieren von Gehirnzellen oder das Einbringen von neuronalen Stammzellen ins Nervensystem geschehen.
• Damit das irgendwann funktioniert, braucht es aber zunächst ein tiefergehendes Verständnis sowohl der schädigenden Prozesse als auch der Regenerationsfähigkeit und der Funktionsweise neuronaler Schaltkreise.
Olivbrauner Rücken, hellgelber Bauch, Zebramuster auf den Seiten. Beheimatet im Stromgebiet des Ganges, zieht der Zebrafisch heutzutage auch in zahlreichen Forschungslaboren seine Bahnen. Dies liegt vor allem an einer besonderen Fähigkeit: Die Fische können abgestorbene Nervenzellen ersetzen und so ganze Hirnregionen wiederherstellen. Beim Menschen und anderen Säugetieren führen Verletzungen des zentralen Nervensystems sowie neurodegenerative Krankheiten in der Regel zu dauerhaften und oft schwerwiegenden Schäden wie Lähmungen, Sprachstörungen, Verlust kognitiver Fähigkeiten oder Epilepsie. Es ist also kaum überraschend, dass sich Forscher rund um den Globus für das Nervensystem des Fischs interessieren und versuchen, die zugrundeliegenden Mechanismen der Selbstheilung zu entschlüsseln.
Narbenfreies Gehirn
Jovica Ninkovic, Gruppenleiter am Institut für Stammzellforschung des Helmholtz Zentrums München, untersucht gemeinsam mit seinen Mitarbeitern, wie sich das Gehirn von Zebrafischen nach Stichverletzungen regeneriert. „Auffallend ist, dass sich Wunden bereits wenige Tage nach der Verletzung ohne Narbengewebe schließen“, so Ninkovic. Ähnlich wie auch beim Menschen sammeln sich in der Nähe der Wunde so genannte Gliazellen. Dabei handelt es sich um all jene Zellen im Nervengewebe, die sich strukturell und funktionell von den Nervenzellen abgrenzen lassen. Anders als beim menschlichen Gehirn führt beim Zebrafisch die Rekrutierung von Gliazellen jedoch nicht zu einer Narbenbildung. Die Ergebnisse der Wissenschaftler deuten darauf hin, dass dies daran liegt, dass die Gliazelltypen, die zu Reparaturzwecken heraneilen, ganz spezifisch zusammengesetzt sind. Nun geht es darum, die molekularen Mechanismen zu entschlüsseln, die an diesen vorteilhaften Glia-Reaktionen beteiligt sind.
Das Ausbleiben einer Narbe reicht aber nicht aus, damit sich das zerstörte Gewebe auch vollständig regeneriert. Stattdessen muss das beschädigte Netzwerk gewissermaßen wieder geflickt werden. Kein Problem für den Zebrafisch – übrigens auch nicht für viele weitere Fische und bestimmte Salamanderarten. Ihr Leben lang können diese Tiere ausreichend neue Nervenzellen bilden und so für Ersatzmaterial sorgen. Ninkovic und seine Kollegen untersuchen in diesem Zusammenhang, wie die neu erzeugten Neuronen zur funktionellen Wiederherstellung der neuronalen Schaltkreise beitragen.
Beim Menschen (und auch bei Säugetieren im Allgemeinen) stellt sich die Situation anders dar: Zwar ist mittlerweile klar, dass auch das erwachsene Gehirn über so genannte neurale Stammzellen verfügt. Diese können sich zu Nervenzellen entwickeln – Experten sprechen von der adulten Neurogenese. Allerdings sind neurale Stammzellen bei Erwachsenen nur noch in sehr wenigen Gehirnregionen vertreten. Wozu die adulte Neurogenese dient, ist noch nicht abschließend geklärt. Vieles deutet jedoch darauf hin, dass eine Eingliederung von neugeborenen Nervenzellen in reife neuronale Schaltkreise allenfalls in wenigen spezialisierten Nischen des Säugergehirns stattfindet. Nach Hirnverletzungen oder bei neurodegenerativen Krankheiten wie Parkinson oder Alzheimer werden neue Nervenzellen nach heutigem Wissensstand offenbar kaum gebildet. Ein Verlust an Neuronen führt üblicherweise dazu, dass sich bereits bestehende neuronale Netzwerke erheblich umstrukturieren. Das reduziert die funktionellen Beeinträchtigungen mitunter, aber sie verschwinden in der Regel nicht vollständig.
Ninkovic hofft allerdings, dass sich die adulte Neurogenese womöglich ankurbeln lässt: „Wir suchen unter anderem nach den molekularen Faktoren, die für die Entstehung bestimmter Nervenzelltypen im Gehirn erwachsener Säugetiere ausschlaggebend sind“, so der Wissenschaftler. Die Erkenntnisse könnten dazu dienen, entsprechende molekulare Kaskaden zu aktivieren, die wiederum die Bildung bestimmter Neuronentypen induzieren. So ließe sich womöglich der Verlust von Neuronen nach Verletzungen oder Krankheiten kompensieren.
Recommended articles
Überraschende Entdeckung
Genauso wie ihr ehemaliger Mitarbeiter Ninkovic erforscht auch die Neurobiologin Magdalena Götz die Regeneration des Nervensystems. Götz ist Direktorin des Instituts für Stammzellforschung am Helmholtz Zentrum München und Inhaberin des Lehrstuhls für Physiologische Genomik an der Ludwig-Maximilians-Universität München. Eine ihrer wichtigsten Entdeckungen stammt jedoch nicht vom Zebrafisch, sondern aus Versuchen mit Mäusen. Um die Jahrtausendwende konnten sie und ihre Mitarbeiter zeigen, dass Gliazellen Stammzelleigenschaften haben und sich zu Nervenzellen entwickeln können. Diese Erkenntnis war eine kleine Sensation, widersprach sie doch der damaligen Lehrmeinung.
„Mittels ins Gehirn eingebrachter Stoffe versuchen wir nun, Gliazellen so zu programmieren, dass sie Nervenzellen bilden“, erklärt Götz. Bei Mäusen ist das dem Team bereits gelungen. Noch ist aber offen, ob diese neuen Nervenzellen auch die richtigen Verbindungen ausbilden und ein beschädigtes Netzwerk tatsächlich reparieren. „Wir müssen verstehen, unter welchen Bedingungen die neuen Nervenzellen sinnvoll zu einer Regeneration beitragen“, sagt Götz. „Es könnte nämlich auch sein, dass sie Fehlfunktionen hervorrufen.“ Daher sei es enorm wichtig, zunächst die Funktionsweise der neuronalen Schaltkreise besser zu verstehen.
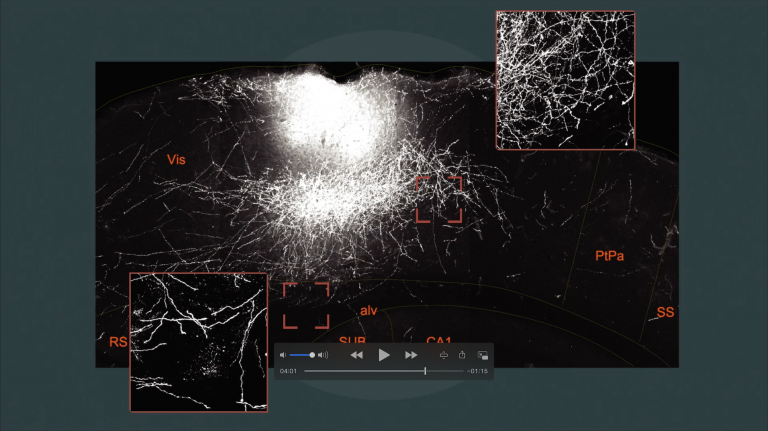
Gleiches gilt auch bei anderen Strategien der Hirnreparatur: Bereits seit etlichen Jahren versuchen Götz und andere Forscher dem Gehirn von Mäusen neue Nervenzellen zuzuführen – zum Beispiel durch Einbringen von Stammzellen oder Transplantation von jungen Neuronen. Diese neuen Zellpopulationen sollen helfen, beschädigte Areale wieder aufzubauen. Das Team um Götz brachte etwa den Beweis, dass sich transplantierte embryonale Neuronen innerhalb von drei Monaten in verletzte Nervenzellschaltkreise integrieren können. Die neuen Exemplare weisen dann die gleichen funktionellen Eigenschaften auf wie die vorhandenen Neuronen. Zumindest wenn ein ausreichender Teil des bereits bestehenden neuronalen Netzwerks noch verfügbar ist, sind künftig solche Ersatztherapien denkbar. Vorher ist aber noch viel Forschungsarbeit nötig: „Unsere neuesten Versuche zeigen, dass die direkte Umgebung der abgestorbenen Zellen entscheidend für die Integration neuer Nervenzellen ist“, berichtet Götz. „Daher müssen wir erst die unterschiedlichen Schäden im Gehirn – hervorgerufen etwa durch einen Schlaganfall oder die Alzheimer-Krankheit – im Detail verstehen, um abgestorbene Nervenzellen durch neue funktionell ersetzen zu können.“
Rückenmark neu verknüpfen
Ähnlich wie bei den Gehirnarealen können sich auch zerstörte Rückenmarksstrukturen normalerweise nicht wieder regenerieren. Ist das Rückenmark einmal vollständig durchtrennt, wächst es nicht wieder zusammen. Die Betroffenen bleiben dauerhaft gelähmt. Das liegt vor allem an einem bestimmten Nervenfaserzug namens Kortikospinaltrakt. Er läuft von der Hirnrinde, dem Cortex, ins Rückenmark und ist maßgeblich verantwortlich für die willentliche Steuerung der Körpermuskulatur.
Dieser Nervenfaserzug sendet mehr als eine Million Neuronen aus, die normalerweise in den ersten zwei Lebensjahren angelegt werden. Wird er durchtrennt, kann er sich in der Regel nicht wieder neu verknüpfen.
Bestehen jedoch nach einer Verletzung noch Restverbindungen, gibt es Hoffnung: „Eine mögliche Regeneration hängt entscheidend von der Umgestaltung bestehender Nervenzellschaltkreise ab“, erklärt Florence Bareyre, Leiterin der Forschungsgruppe „Spinal Cord Repair“ am Institut für klinische Neuroimmunologie der Ludwig-Maximilians-Universität in München. Beispielsweise kann ein durchtrennter kortikospinaler Trakt nach einer unvollständigen Rückenmarksdurchtrennung – gewissermaßen über Umwege – wieder neue funktionelle Verbindungen herstellen.
Bareyre und ihr Team erforschen, wie dieser Regenerationsprozess abläuft: Welche Synapsen bleiben erhalten, welche werden entfernt? Was ist nötig, damit neue Synapsen entstehen? Und wie funktioniert die Integration der neuen Netzwerke in die bestehenden Strukturen? Die Antworten auf diese Fragen könnten helfen, Mittel und Wege zu finden, um diese Umstrukturierung gezielt zu stimulieren. So ließen sich womöglich Rückenmarksverletzungen zumindest teilweise heilen.
„Wir haben bereits Moleküle identifiziert, die offenbar die Bildung von neuen Kontakten im verletzten Kortikospinaltrakt auslösen können.“ Jetzt gilt es, die grundlegenden Prinzipien dieser Neuvernetzung weiter zu entwirren. Denn ein besseres Verständnis der zugrundeliegenden Mechanismen würde wesentlich dazu beitragen, neue therapeutische Strategien zur Behandlung von Rückenmarksverletzungen zu entwickeln, ist Bareyre überzeugt. Es besteht also durchaus Hoffnung, dass es in Zukunft tatsächlich möglich sein wird, Verletzungen des Nervensystems zu heilen – etwas, was für den Zebrafisch selbstverständlich ist.
Zum Weiterlesen:
- Roger AB et al.: New approaches for brain repair – from rescue to reprogramming. Nature 2018 May;557(7705):329-34 (zum Abstract)
https://www.ncbi.nlm.nih.gov/pubmed/29769670 - Falkner S et al.: Transplanted embryonic neurons integrate into adult neocortical circuits. Nature 2016 Nov;539(7628):248-53 (zum Abstract).
https://www.ncbi.nlm.nih.gov/pubmed/27783592 - Grade S and Götz M: Neuronal replacement therapy: previous achievements and challenges ahead. NPJ Regen Med. 2017 Oct;23;2:29 (zum Volltext)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5677983/ - Baumgart EV et al.: Stab wound injury of the zebrafish telencephalon: a model for comparative analysis of reactive gliosis. Glia. 2012 Mar;60(3):343-57 (zum Abstract).
https://www.ncbi.nlm.nih.gov/pubmed/22105794 - Bradley PM et al.: Corticospinal circuit remodeling after central nervous system injury is dependent on neuronal activity. J Exp Med. 2019 Aug;pii: jem.20181406. doi: 10.1084/jem.20181406. [Epub ahead of print] (zum Abstract)
https://www.ncbi.nlm.nih.gov/pubmed/31391209