T-Zellen bei Schlaganfall: Nicht schwarz, nicht weiß
Nach einem Schlaganfall wandern T-Zellen in großer Zahl zur Verletzung – und machen anfangs alles nur noch schlimmer.
Scientific support: Prof. Dr. Andreas Meisel
Published: 20.06.2021
Difficulty: intermediate
- Das Gehirn ist durch die Blut-Hirn-Schranke vor giftigen Stoffen und Krankheitserregern abgeschirmt. Auch Immunzellen wie die T-Zellen dürfen eigentlich nicht passieren, weil sie Schaden anrichten könnten.
- Beim Schlaganfall wird Hirngewebe durch mangelnde Durchblutung zerstört. Anschließend lässt das Gehirn Immunzellen, darunter T-Zellen, eindringen.
- Es gibt Hinweise darauf, dass die Anwesenheit von T-Zellen anfangs den Gewebeschaden vergrößert. Auf die Regeneration im Anschluss an den Schlaganfall wirken sie sich jedoch positiv aus.
- Spezielle Trainingsprogramme, die die Erholung nach einem Schlaganfall fördern, wirken besser, wenn ausreichend T-Zellen vorhanden sind.
- Die Erkenntnisse der Forschung sollen helfen, neue Therapien und bessere Regenerationsprogramme für Schlaganfallpatienten zu entwickeln.
Fast pausenlos ist unser Körper damit beschäftigt, unerwünschte Eindringlinge abzuhalten oder zu vernichten. Die erste Verteidigungslinie ist das angeborene Immunsystem. Dazu zählen etwa unsere Haut und die Schleimhäute, die Barrieren für Krankheitserreger und Giftstoffe bilden, oder bestimmte Abwehrzellen, die diese rasch beseitigen. Alles, was diese ersten Abwehrmechanismen überwindet, bekommt es mit dem adaptiven Immunsystem zu tun. Dieser Teil der Verteidigung reagiert deutlich langsamer, dafür aber auch gezielter. Bestimmte Typen von T-Lymphozyten, kurz T-Zellen, patrouillieren etwa durch die Blutbahn und suchen nach fremden Stoffen und Mikroorganismen. Werden sie fündig, wird ein ganzes Heer an zusätzlichen Kämpfern und Helfern rekrutiert, was in der Regel zu Entzündungen führt. So werden Infektionserreger effizient beseitigt und Gewebeschäden repariert.
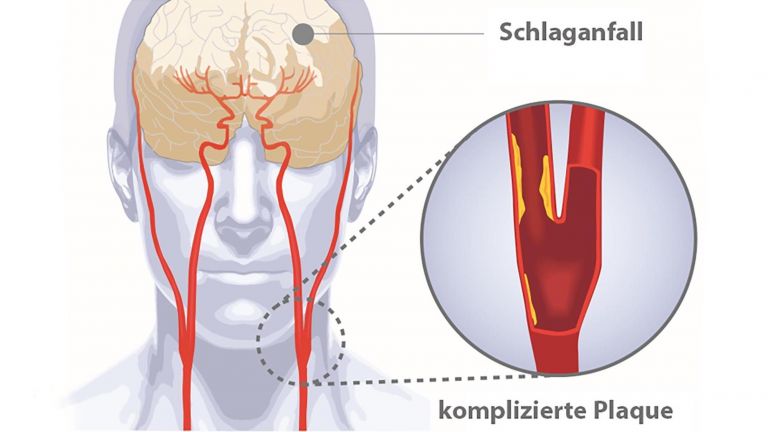
Im Gehirn sieht die Sache allerdings etwas anders aus: Das Organ ist gegen toxische Stoffe und schädliche Erreger durch die Blut-Hirn-Schranke relativ gut abgeschirmt. Die Barriere besteht aus Eiweißmolekülen, die die Zellmembranen wie einen Reißverschluss verbinden und nur für wenige und ganz bestimmte Stoffe durchlässig sind. Auch Immunzellen passen eigentlich nicht hindurch. Das hat einen einfachen Grund: In der Regel agieren die Abwehrzellen in Entzündungsherden ziemlich aggressiv und vernichten nicht nur Erreger und kranke Zellen, sondern erwischen auch immer gesunde Exemplare. So zerstören sie intaktes Gewebe. Normalerweise garantiert diese Taktik, dass wirklich alle Keime restlos beseitigt werden. Und da Gewebe in der Regel nachwachsen kann, ist dieser Kollateralschaden sozusagen das kleinere Übel. Nicht so im Gehirn. Hier gilt: Was weg ist, ist weg. Neuronen können mit wenigen Ausnahmen nicht nachwachsen, weshalb viele Schäden irreparabel sind. Aus diesem Grund verbarrikadiert sich das menschliche Denkorgan.
Bestimmte Krankheiten allerdings heben das „Einlassverbot“ für Immunzellen auf – darunter auch der ischämische Schlaganfall. Bei dieser Erkrankung wird die Blutversorgung in einer abgegrenzten Gehirnregion plötzlich unterbrochen – meist durch verstopfte Blutgefäße. Als Folge werden die „stromabwärts“ liegenden Nervenzellen nicht mehr ausreichend mit Sauerstoff und Glukose versorgt. Sie sterben ab.
Die verletzten und verendenden Hirnzellen setzen Botenstoffe ins Blut frei, was unter anderem andere Zellen im Gehirn dazu veranlasst, etwa die so genannten ▸ Mikrogliazellen, Entzündungsstoffe abzusondern. Durch die unterschiedlichen Botenstoffe werden Immunreaktionen im Körper ausgelöst. Darüber hinaus wird die Blut-Hirn-Schranke in den ersten Tagen nach dem Schlaganfall durchlässiger. Das führt auch dazu, dass Immunzellen ins Gehirn eindringen.
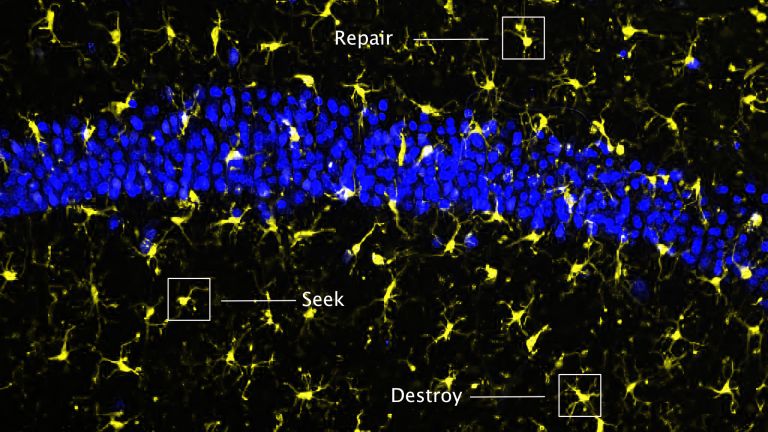
„Der genaue zeitliche Ablauf sowie die Anzahl der verschiedenen Immunzellen, die nach einem Schlaganfall in das Hirn infiltrieren, unterscheiden sich je nach Modell teilweise erheblich voneinander“, sagt Christoph Kleinschnitz, Professor für Neurologie am Universitätsklinikum Essen. Klar ist, dass T-Zellen einige Tage nach dem Schlaganfall an der Grenze zur Infarktregion in großen Mengen vorhanden sind, wie Wissenschaftler in Gewebeproben bei Verstorbenen herausfanden. In Nagern konnten sie etwa einen Tag nach dem Schlaganfall T-Zellen nachweisen. „Vieles deutet darauf hin, dass die T-Zellen wohl schon innerhalb weniger Stunden nach der Verletzung rekrutiert werden und die Akkumulation ihren Höhepunkt drei bis vier Tage danach erreicht“, sagt Kleinschnitz. Die T-Zellen blieben dann bis zu sieben Wochen nach dem Schlaganfall im Gehirn.
Entzündung: schädlich oder nützlich?
Den Zweck der ausgelösten Entzündungskaskaden verstehen Fachleute noch nicht im Detail. Bei einem beträchtlichen Teil der Patienten wächst der Infarkt weiter, obwohl die Verstopfungen in den Blutgefäßen erfolgreich beseitigt wurden. Dieses Phänomen bezeichnen Fachleute als Reperfusionsschaden. „Man vermutet, dass dies eine Folge der Entzündung ist“, sagt Kleinschnitz. Welche Rolle die unterschiedlichen Protagonisten des Immunsystems aber dabei jeweils spielen, ist noch unklar. Studien an genveränderten Mäusen offenbarten aber, dass T-Zellen zumindest zu gewissen Teilen an der Verschlechterung Schuld tragen. Die akuten Verletzungen durch einen Schlaganfall fielen bei Tieren ohne T-Zellen durchweg geringer aus als bei normalen Mäusen. Hemmten Forscher die Migration der T-Zellen in das Gehirn der Nager, so reduzierte das ebenfalls den Gewebeschaden. Die Abwesenheit von T-Zellen wirkte sich außerdem positiv auf neurologische Ausfallerscheinungen wie zum Beispiel Lähmungen aus. Injizierten die Forscher den genetisch veränderten Mäusen vor dem Schlaganfall T-Zellen, entwickelten sie gleich große Infarkte wie normale Mäuse.
Einiges spricht dafür, dass an dieser Beobachtung insbesondere T-Zelltypen schuld sind, die eigentlich überschießende Entzündungsreaktionen verhindern sollen – die so genannten regulatorischen T-Zellen. Schalteten Forscher diesen Zelltyp in Mäusen gezielt aus, verringerte sich 24 Stunden nach dem Schlaganfall die Infarktgröße dramatisch. Zusätzlich verbesserten sich neurologische Funktionen. Dieser Effekt blieb auch in späteren Stadien der Infarktentwicklung erhalten. Eine Vermutung ist, dass die regulatorischen T-Zellen in den Blutgefäßen mit Blutplättchen und bestimmten Bereichen der Gefäße interagieren und so das Verklumpen weiter anheizen.
„Diese und weitere Erkenntnisse deuten darauf hin, dass der ischämische Schlaganfall zumindest teilweise eine immunvermittelte Krankheit ist“, sagt Kleinschnitz. Er und andere Experten warnen jedoch davor, die Migration der T-Zellen ins Gehirn pauschal als „schädlich“ einzustufen. Selbst in der akuten Phase des Schlaganfalls könnten T-Zellen entscheidend dazu beitragen, eindringende Krankheitserreger abzuwehren, Gewebetrümmer zu beseitigen und die Entzündungsreaktion zu kontrollieren. So zeigte sich in Mäusen, dass die regulatorischen T-Zellen in den Tagen nach dem Schlaganfall durchaus eine schützende Wirkung entfalten, indem sie eben genau das tun, was sie sollen: die Entzündungsreaktion kontrollieren und steuern.
Recommended articles
Entzündung unterstützt Regeneration
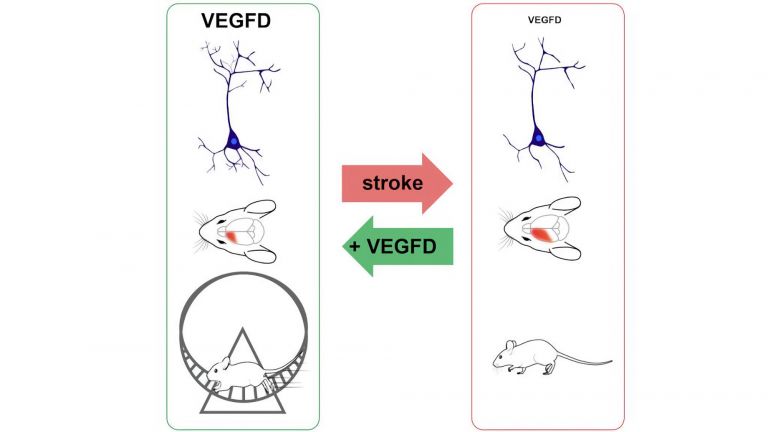
Insbesondere in den Wochen nach dem Schlaganfall tragen T-Zellen wahrscheinlich wesentlich zu der funktionellen Erholung des Gehirns bei. Die Regenerationsphase tritt üblicherweise Tage bis Wochen nach dem Schlaganfall ein. Je nach Lage, Größe und Schwere der Verletzung können Betroffene verlorengegangene Funktionen teilweise oder sogar vollständig wiederherstellen. In einer Untersuchung an Mäusen fanden Forscher, dass die vermehrte Anwesenheit bestimmter Immunzellen – darunter auch eine bestimmte Klasse von T-Zellen – die beschädigten Bereiche verkleinerte und neurologische Defizite verbesserte. Diese Entwicklung war bereits nach einigen Tagen zu beobachten.
Die Regeneration des Gehirns beruht hauptsächlich auf seiner so genannten neuronalen Plastizität – also der Fähigkeit, sich neu zu organisieren, indem es neue Nervenbahnen und Synapsen bildet. So kann das Organ den Verlust an Neuronen zumindest teilweise kompensieren. „Man vermutet, dass sich die langfristige Anwesenheit von bestimmten T-Zellen positiv auf die neuronale Plastizität auswirkt“, sagt die Infektionsimmunologin Wiebke Hansen, Professorin am Universitätsklinikum Essen. Dies könne beispielsweise durch die Produktion bestimmter Moleküle erfolgen, die die Regeneration förderten.
Regenerationstherapie besser mit T-Zellen
In der klinischen Praxis hat sich gezeigt, dass gezielte Trainingsprogramme die Regeneration nach einem Schlaganfall beschleunigen können. Professor Jens Minnerup, Oberarzt an der Klinik für Neurologie mit Institut für Translationale Neurologie des Universitätsklinikums Münster berichtet über vorläufige Ergebnisse: „Interessanterweise zeigen erste Arbeiten, dass das Vorhandensein von T-Zellen offenbar eine Voraussetzung für die trainingsinduzierte Schlaganfallregeneration ist.“ Es gebe sogar Hinweise, dass das Training wiederum die Anzahl bestimmter Immunzellen inklusive eines T-Zelltyps erhöht. Nun wollen Forscher um Hansen und Minnerup genauer herausfinden, wie sich T-Zellen im Gehirn und Trainingstherapie gegenseitig in den Wochen nach dem Schlaganfall beeinflussen. Dazu planen sie, zunächst bei Mäusen zu untersuchen, wie Training das räumliche Verteilungsmuster der T-Zellen im Gehirn verändert. Sie hoffen dadurch, T-Zell-vermittelte Trainingseffekte zu identifizieren, die das Wachstum der Nervenbahnen und die Erregbarkeit der Neuronen unterstützen. Langfristig möchten die Forscher das gewonnene Wissen dazu nutzen, die Regenerationstherapie nach einem Schlaganfall zu verbessern.
Zum Weiterlesen
- Brait VH et al.: Importance of T lymphocytes in brain injury, immunodeficiency, and recovery after cerebral ischemia. J Cereb Blood Flow Metab. 2012 Apr;32(4):598-611. (Zum Volltext).
- Liesz A et al: Inhibition of lymphocyte trafficking shields the brain against deleterious neuroinflammation after stroke. Brain. 2011 Mar;134(Pt 3):704-20. (Zum Abstract).